冻库环境中利用STEM了解鳗鱼体液细胞冰晶纳米颗粒变化
冻库一般温度都在-18 ℃以下环境,让物品冰晶颗粒生成而迅速冻结的方法。物品在冻结过程中会发生各种各样的变化,如物理变化,细胞组织变化以及生物和微生物变化等。主要用于低温实验室、食品、药品、化工原料的快速冷冻达到保持物理特性和保鲜的目的。以下我们通过科学实验技术了解鳗鱼体液细胞冰晶纳米颗粒变化
为了进一步了解冻库中纳米粒子在水悬浮液中的行为,需要对纳米粒子的分散和表面涂层进行原位表征。用低温透射电镜(cryo-TEM)可以分析纳米粒子在冷冻、水化状态下的悬浮状态,但这种分析往往仅限于成像。这项工作证明了分析扫描透射电子显微镜(scanning transmission electron microscopy,STEM)首次用于检测在玻璃体冰层中捕获的纳米粒子。利用STEM能量色散X射线(EDX)光谱和电子能量损失谱(EELS)对冷冻水合悬浮液在冻库低温条件下的成像和分析,证实了CeO 2、Fe2O3、ZnO和Ag纳米粒子在悬浮液中的鉴别和分离。在STEM(<2000 e-/O2)中,电子束引起的损伤比CTEM(<100 e-/a2)高得多,这是由于玻璃化冰中产生的辐解产物所造成的扩散有限损伤。对分散在细胞培养介质中的钛酸钡生物标志物纳米颗粒进行了冻库低温分析STEM的进一步应用,观察了悬浮在介质中纳米粒子周围形成的富Ca和P涂层。这种以前未被报道的涂层在接触细胞时改变了生物标记物的表面化学。因此,我们表明,这项技术有潜力提高我们对纳米粒子在冻库复杂的水悬浮液中的基本行为的理解。

1、冻库中冰晶纳米粒子介绍
透射电子显微镜(TEM)是纳米粒子表征的前沿技术。高分辨率成像可以确定冰晶纳米粒子的二维投影尺寸和形状,光谱分析可以确定冰晶纳米粒子的元素组成。使用扫描电镜(STEM)最常用的方法是实现样品组成元素的空间映射。
结合能量色散X射线(EDX)光谱和电子能量损失谱(EELS).然而,由于透射电镜的真空要求,在原位或自然状态分析方面存在局限性,特别是固-液分散和多相互作用的相关研究。
为了满足对分散在冻库液体中的冰晶纳米粒子进行原位表征的需要,最近的发展导致了用于透射电镜的液体细胞的出现。通过该技术的应用,捕获了冻库环境下纳米粒子的生长(1)、冰冻结晶(2)和一些生物过程(3)等动态过程。最初的缺点意味着无法完成元素分析或绘图,Lewis等人已经克服了这些缺点。(4)成功地演示了多组分纳米颗粒悬浮液的液体细胞成像和EDX分析。但也有一些局限性:液体细胞分析的主要缺陷是液体悬浮液中产生的束致效应;对于悬浮在水溶液中的样品,在电子束照射下,水的辐解迅速发生,在入射电子与水分子之间能量传递的10 ps范围内产生水合电子(EH)和OH·、H·和H2·自由基的产物。然后,这些反应物种会发生进一步的反应,产生H2O2、H3O和H2O·(5)的附加损伤产物。在微秒内,这些物种在溶液中扩散并相互反应,并与液体中的周围分子和粒子发生反应(6)。此外,在没有竞争过程的情况下,H3O含量的增加可能会导致溶液pH值的下降。虽然这些损坏机制和产品可以用来驱动动态过程(7),但它们对准确描述起始溶液和悬浮产品是非常有害的。即使在相对较低的电子注量(<100 e-/a2)(8)下,也会发生辐照引起的水性悬浮介质的改变。在STEM条件下,在每像素/帧平均通量接近140 e-/(2.s)的条件下,由于悬浮液中产生的辐解产物引起的冰晶纳米粒子表面电荷的改变,冰晶纳米粒子团簇可以在几秒钟内分裂和移出视场。
一种替代液体细胞TEM的方法是在<-165 oC(冻库超低温技术TEM)的温度下的制冷设备。一个样品被涂在TEM的网格上,然后迅速陷入低温冻库中,通常是液态乙烷,因此悬浮在一层电子透明的玻璃化冰中被捕获。快速玻璃化液体的过程确保了样品在自然状态下被捕获,即不需要悬浮液的再分散或结晶,也不需要水化表面的真空诱导干燥。Cryo-TEM通常与近原子分辨率(10)的生物分子结构的测定有关,但最近已被用于研究有机溶剂(12)中的液晶结构(11)和金纳米粒子聚集的有序性。
与液体细胞透射电镜相比,冻库低温透射电镜有很大的好处:首先,玻璃化冰相对于液态水的较低温度可能导致一些(如果不是全部的话)损伤机制的反应速率降低(13,14)。因此,悬浮液和纳米粒子样品的辐射损伤率可以很好地降低。此外,水的辐解是一个扩散受限的过程(6),在玻璃化温度(-137 oC)以下的非晶态固体中的扩散速率比在液体(15)慢几个数量级。玻璃化冰在-165 oC辐射分解过程中产生的反应物(如Eh、OH·、H·、H2·H2O2、H3O和H2O·)的扩散速度比在液态水中缓慢,减少了玻璃化冰(16)的二次损伤。此外,如果悬浮冰在结构上保持完整,粒子的自然分散应该保持不变。例如,该技术(17)报道了分散在细胞培养介质中的纳米粒子的团聚,甚至可以解释(18)纳米颗粒团块的压扁作用。
低温透射电镜还去除成分干燥工艺品,以及防止物理运动发生在常规滴铸TEM样品制备。我们以前已经证明,在通过常规或冷冻法制备的细胞培养介质中,EDX光谱所提供的纳米粒子分散体所提供的元素组成信息有显著差异(19)。现在的要求是提高我们进行低温分析STEM以获得空间分辨元素分布的能力。这一领域的研究仍处于起步阶段,只有有限的研究使用了这一技术(20,21)。在进行思民冻库低温分析STEM时,主要考虑因素仍然是玻璃体冰中的辐解和由此造成的损害。最重要的是,冰会融化,导致纳米粒子的移动,在此之前,玻璃化悬浮介质中产生的活性物质可能会改变纳米粒子的结构和组成。
在这里,我们提出了一项研究,我们最初使用一个测试样品,其中包括一个简单的冰晶纳米粒子分散在水中,以确定和确定临界通量,超过这个临界通量,在常规TEM(CTEM)和STEM成像中都会对玻璃冰造成重大损害,以及注量率对此可能产生的影响。结果表明,与高通量STEM相比,电子束在CTEM中产生的损伤发生在较低的电子流量下,这是由于玻璃化冰中产生的辐解产物的扩散损伤所致。此外,我们还评估了冷冻冰晶STEM EDX和鳗鱼光谱的有限灵敏度,以及对晶格成像的空间分辨率的限制。然后,利用分散在细胞培养介质中的钛酸钡(BaTiO 3)生物标记纳米颗粒体系,展示了裆裤低温分析STEM对固液界面特征的适用性,以确定源于介质组分的表面涂层。
(二)、实验材料和方法。
2.1样品准备
用50μg/ml氧化铁(Ⅲ)、40 nm(氟卡化学试剂,批号40095/1.22/00)、100μg/ml二氧化铈、10 nm(联合研究中心,NM-211)、50μg/ml氧化锌,制备了去离子水中的多纳米颗粒模型悬浮液。一次粒径20~60 nm(Nanotek,ZH1 121 W CAS#1314-13-2)和20μg/ml金银核壳,一次粒径20 nm(Sigma-Aldrich银分散块#MKB 19138V),纳米颗粒。
为研究固体纳米粒子与复合多组分液体的相互作用,将钛酸钡(BaTiO 3)纳米粒子在150℃下水热合成72 h(22),分散在添加10%胎牛血清(FBS)、1%链霉素和青霉素的RPMI培养基中。在去离子水中加入1mg/ml BaTiO 3纳米颗粒,在完整的细胞培养基中稀释至100μg/ml,声纳5h后进行表征。
样品是用FEI维特机器人c(马克IV)冷冻库准备的。将一滴3.5μ1的悬浮液置于定量箔透射电镜栅极(R1.2/1.3;EM分辨率)或莱西碳涂层透射电镜网格(EM分辨率)上,在印迹力6处涂抹,然后进入液态乙烷。透射电镜用Gatan 914制冷机,冻库温度保持在摄氏-165℃以下,以防止反玻璃化。通过对厚度<200 nm的区域进行分析,发现冰层厚度在网格上是可变的。
2.2冻库低温透射电镜
使用FEI Tian 3 Themis G2在300 kV下运行,安装了FEI超级X 4探测器EDX系统、Gatan单视角CCD和Gatan量子965 ER成像滤波器。采用探针电流40~100 Pa(用法拉第杯校准的流感凸轮剂量计测量)、会聚半角8.2Mrad和探针尺寸1.4个小时(用硅片上HAADF图像分辨率测量)进行冷STEM。Bruker ESPRIT v1.9软件用于cryo-edX的收集,没有对任何报告的数据集进行后处理。
采用电子损耗近边缘结构(Elnes)或光谱成像(SI)条件进行冷冻鳗鱼实验.对于Elnes条件,在Gatan显微镜套件(V.3.0.1)(GMS)采集软件中使用了高信号(HI-RES)设置,相当于2.5毫米光谱仪的入口孔径,不进行绑定。色散为0.25eV/ch,收集角和收敛角分别为21和8.2mrad。为了收集鳗鱼的光谱,电子束不断地发出。
扫描整个图像区域,以了解鳗鱼光谱的总曝光时间。模型纳米粒子系统采用高损耗漂移管电压660 eV,曝光60 s,放大115 K倍或230 K倍。对于SI,在GMS软件中采用5mm光谱仪入口孔径和130 x垂直联调的高速(Hi-SNR)设置。采用0.5eV/ch色散,收集角和收敛角分别为11.2和8.2mrad。
EELS和EDX光谱均不采用亚像素扫描。
2.3电子通量和注量测量
2.3.1 [医][=conventional transmission electron microscope]普通透射电子显微镜,常规透射电子显微镜
电子注量和通量用下列公式计算:
𝐸𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑓𝑙𝑢𝑒𝑛𝑐𝑒 (𝑒 −/Å2 ) = 𝑁𝑒 /𝐴
𝐸𝑙𝑒𝑐𝑡𝑟𝑜𝑛 𝑓𝑙𝑢𝑥 (𝑒 −/(Å2. 𝑠)) = 𝑓𝑙𝑢𝑒𝑛𝑐𝑒/𝑡
其中Ne是图像中电子之和,用GMS中的摄像机标定后得到的,A是在O2中的总图像面积,t是图像的捕获长度(S)。另外,Gatan单视角CCD的采集例程允许获取预先设置的电子注量图像。
2.3.2 scanning transmission electron microscope 扫描透射式电子显微镜
已经报告了两种电子通量,在每个像素处接收的局部电子探针通量又被称为Fp,并且更常见的被称为Fav的平均电子通量,该平均电子通量是在整个帧上的平均通量。
𝐹𝑝 = 𝐼/(𝑒𝐴𝑝 )
𝐹𝑎𝑣 = 𝐼/(𝑒𝐴𝑓 )
其中I是C/s中的探针电流,e=1.602 x 10-19是C中的电子电荷,AP是直径为1.4的探针的面积,Af是框架在O2中的总扫描面积。从Fav中可以计算出每次扫描累积的总电子注量乘以t,以s为单位的总扫描时间乘以像素的总停留时间乘以总像素数。
𝑇𝑜𝑡𝑎𝑙 𝑎𝑐𝑐𝑢𝑚𝑢𝑙𝑎𝑡𝑒𝑑 𝑓𝑙𝑢𝑒𝑛𝑐𝑒 (𝑒 −/Å2 ) = 𝐼𝑡/(𝑒𝐴𝑓 )
3。结果和讨论
3.1纳米颗粒模型悬浮液
3.1.1相位对比度冷TEM
在低剂量条件下,对<100 e-/a2(电子通量<20e-/(j2.s)图像进行了总通量小于100 e-/a2(电子通量<20e-/(j2.s)的目标孔径(21 Mrad)成像,并在特定区域的快速傅立叶变换(Fft)中测量了晶格间距。这些图像(图1)。通过对(111)、(002)和(022)晶格面的d-间距分别为3.1、2.7和1.9确定了CeO_2的存在(图1-A)。由于ZnO和Fe2O3重叠(在实验不确定范围内)中某些晶格面的d间距,无法确定其它组分。TEM图像中两个区域的d间距测量结果可以与ZnO的(101)晶格面或Fe2O3的(311)晶格面(图1-C,D)相对应。
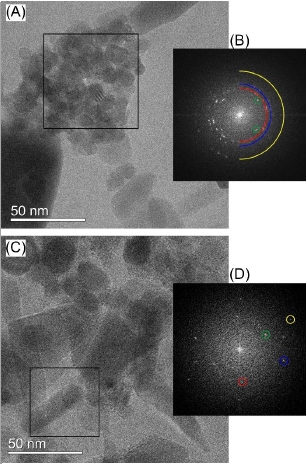
图1:模型纳米粒子分散在冻库环境中含CeO 2、ZnO、Fe2O3和Au-Ag核壳纳米粒子中的冷冻-CTEM图像。从每幅图像中的一个区域得到快速傅里叶变换(FFT)。图像中的区域(A,黑匣子)给出相应的FFT(B)中可归因于CeO 2(111)(红色)、(002)(蓝色)和(022)(黄色)和Fe2O3(201)(绿色)的斑点。图像(C,黑匣子)中的区域给出相应的FFT(D)中可分配给Fe2O3(例如(201)绿色和(211)红色)或Fe2O3或ZnO(例如蓝色Fe2O3(311)或ZnO(101)和黄色(Fe2O3(410)或ZnO(102)的点。
图1中的图像放大了230 K次,为了防止冰冻融化,必须使用极低强度的电子束(总电子注量<100 e-/a2)。这导致在识别和聚焦所期望的形象方面遇到困难。更高的放大成像需要更高的电子注量才能达到类似的信噪比,这就导致了冻库中玻璃化冰的快速破坏。
3.1.2 Cryo-STEM与cryo-CTEM
我们定性地观察到,在STEM条件下,与CTEM中使用的相同量级的总电子通量/谱对冰的破坏要小得多。在CTEM中暴露于总通量为400 e-/a2且通量为100 e-/(j2.s)的情况下,冰受到严重损害,但在STEM中暴露于总电子注量为1000 e-/a2,FP为24x107e-/(j2.s)和Fav为14e-/(a2.s)后,样品只显示了冰的轻微损伤(图2)。在STEM中超过1000 e-/a2的总通量,HAADF图像中可以检测到对冰的轻微损伤。总通量在1500~4000 e-/O2之间对冰造成了更大的破坏,但没有发生总熔化,纳米粒子在薄膜中的位置保持不变。相反,在CTEM中电子注量超过400 e-/a2时,对冰和样品运动有明显的损伤(图2(B)。在发生严重冰损伤之前,STEM中的总通量可以比CTEM更高,这是一个关键的观测结果,因为对于分析工作来说,较高的通量将确保图像和EDX/鳗鱼光谱中更好的信噪比。然而,严格地说,这种比较只应在相同冰层厚度的地区进行,对冰的损害应通过更多的图像、衍射图或光谱的定量测量来监测。成像将需要使用BF-STEM和与CTEM的相互作用,由于冰的玻璃体性质,衍射具有挑战性,但测量低损耗鳗鱼曝光后的冰厚变化可能是一种可行的方法。

图2:暴露于CTEM和STEM中确定电子通量后对玻璃冰的损伤的定性评估。对于CTEM,使用总通量设置捕获图像。(A)在100e/Å2时,很少发现损坏,(B)在400e/Å2时,观察到在黑色箭头所示的冰中形成气泡,对冰造成重大损坏。对比HAADFSTEM图像之前(注量300e/Å2)(C)和(D)将样品暴露于1000e/Å2的进一步通量后,表明对冰有一定的破坏(在改变对比后插入(D)后,显示了白色箭头所示玻璃冰中观察到的气泡),但远远小于在CTEM较低通量处观察到的值。
很明显,聚焦STEM探针明显改变了玻璃体冰冻的整体损伤率。阀杆通常减少样品的装药,从而降低所观察到的机械应力和试样运动(23)。此外,尽管样品的加热将是极小的,但STEM中的聚焦、高电流密度探头可能比平行光束引起的加热更少,尽管这被认为取决于特定探针的直径和电流;研究表明,超过一定的剂量率,热加热可以增加扩散,从而造成更大的损伤(24)。此外,STEM和CTEM在电子通量上的显著差异也会导致玻璃化冰在一定辐照剂量下的损伤发生变化。提供了一种原理图(图3(A),它假定损伤率可能与电子剂量率(或电子通量)(25)相关联。由于辐射溶解对玻璃化冰(或水)的损伤是扩散性的,在剂量率较高时(即某种形式的幂律依赖关系(指数<1)时,剂量率与损伤率之间存在次线性关系。低剂量CTEM通常使用<10e-/(j2.s)的电子通量进行。相比之下,STEM以极高的局域探针通量工作,对于1.4的探针,其工作顺序为108 e-/(2.s)。
尺寸和60 Pa探针电流,甚至考虑到光束展宽,这仍然是106 e-/(j2.s)(见下文和图3(B)。这里应该注意的是,对于STEM,我们指的是探针通量(FP),而不是每帧平均通量(Fav),后者经常被报告,并且可能比局域探针通量低数量级。假设CTEM通量与示意图和局部STEM探针通量的线性部分对应于剂量率与损伤率曲线稳定的区域,则STEM冻库中单位通量(即曲线梯度)的损伤将比CTEM低,这与我们所观察到的情况一致。
STEM的进一步考虑因素包括:当聚焦(亚纳米)探针穿过试样时,其展宽;我们用Egerton(26)报告的光束展宽方程估计,在100 nm厚的玻璃化冰中,300 keV电子的束展宽约为0.5 nm(由于冰是非晶态的,因此不会有沟道)(图3(B)。此外,离STEM探针位置很远的地方也会有离域损伤,其程度取决于辐射分解所涉及的初级电子激发的能量(因此也取决于这种激发的空间离域)和产物的外扩散和反应活性(27)。水的辐解阈值激发能为7.4eV(28)。由于电子的能量损失与离域距离成反比关系,所以我们可以利用这个阈值(27)来估计电子离域的最大值。在300 kV加速电压下,最大离域距离在2-6nm之间(图3(B)。考虑到这些因素,假设玻璃化冰中TG以下对损伤产物的扩散和反应性有很大的限制,我们推测,类似于(29)中对光束敏感材料的EELS SI提出的跳跃扫描方法,通过将STEM中的样品像素尺寸与加宽探头周围的离域损伤距离相匹配,可以将对玻璃化冰损伤的EELS SI降到最小。从而确保冰不被过量取样。然而,在这种条件下工作的能力将取决于分辨率所需的像素大小和样品的特定激发能量。在我们正在进行的工作中,要确定在预测的离域损害方面是否存在理想的像素大小,同时使用可比较冰层厚度的区域对STEM和CTEM中的冰的损害进行量化,以便开始确定临界剂量。
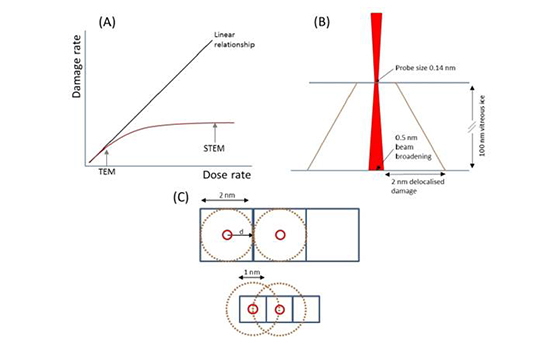
图3:(A)假设剂量率与损伤率之间的关系的原理图(25)。我们推测,冰中扩散有限损伤与剂量率之间的幂律关系是指数<1的(示意图中的红色曲线)。我们建议CTEM工作在一个较低的通量接近这条曲线的线性部分。相比之下,STEM以较高的每像素通量(即探针通量(FP)工作,因此在思民冻库中STEM分析的损伤尺度随着时间的推移比CTEM慢,因此在发现对玻璃体冰的重大损伤之前,STEM冻库中可能存在更高的累积通量。(B)示意图(不标度),显示预计在STEM中将通过100 nm玻璃体冰而产生的光束展宽,以及探头周围计算出的最小离域损伤区(以橙色表示)。(C)(B)显示具有STEM探针大小和估计的离域损伤区域(D)的多个像素的备选视图(D)。缩小像素大小将导致超出成像像素范围的离域损伤,并且会发生过采样。
3.1.3冻库低温阀杆EDX。
采用冷冻-STEM-edX分析,证明模型悬浮液中存在各种不同类型的纳米粒子。当fp为40x107e-/(j2.s),fv为3e-/(j2.s),3 nm像素大小,停留时间为23μs时,总扫描时间为472s,总电子注量为1300 e-/a2。在这些采集条件下,足够的元素信号是
这使得四种纳米粒子中有三种能够被识别和空间分辨(图4-A,B,C,D,E)。检测到与Cu、C(网格)相对应的背景信号,以及Si(被识别为用于初始栅格储存和在进入冷保持架前将网格保持在液态N2下的网格盒中的污染),以及与Zn、Fe和Ce相对应的清晰X射线信号。为了获得金银核壳纳米粒子的信号,需要更高的放大倍数(图4-G)。在较高的放大范围内,电子注量增加,反玻璃化成为一个问题。为了对抗这种情况,需要更短的扫描时间。在这里,一个额外的EDX扫描在更高的放大率(像素尺寸为0.93 nm)164秒,允许金银核壳纳米粒子被映射。这导致进一步的电子流量9100 e-/a2暴露在图4(A)中的盒区。然而,玻璃体冰仍然完好无损。为了得到具有代表性的Au图,采用了特征的Au MαX射线峰,因为Zn Kβ峰(9.572 keV)非常接近Au Lα峰(9.712 keV)。这使得Au更难以获得足够的信号,因此,映射不能确定地显示Au核,但它的存在仍然是通过光谱中检测到的峰值来确认的。
据我们所知,以前还没有对冻库-STEM-edX所使用的流场进行过深入的讨论。Oleshko等人(30,31)在1998/9年度发表的研究中使用了cryo-edX,但没有讨论电子注量,典型扫描持续了3小时才获得任何重要信号。最近,沃尔夫等人。(21)用冷冻-STEM-edX法检测玻璃化细菌中的磷。他们使用的电子通量Fav为16x104e-/(2.s),但没有引用探针通量(FP)或EDX获取的总通量。他们在edX绘图期间对样品进行了重大破坏,但如果没有进一步的信息,很难确定这是由于冰受损或被成像的有机细菌的光束敏感性质造成的。

图4:模型纳米粒子系统在100 Pa下收集472 s(1300 e-/O2)的cryo-edX分析证实了CeO 2、Fe2O3和ZnO纳米粒子的存在。(A)分析了纳米粒子的HAADF STEM图像;(B)Fe Ka EDX地图;(C)Zn Ka EDX地图;(D)该地区的Ce La EDX地图和(E)EDX谱。(F)Fe Ka(红色)、Zn Ka(蓝色)、Ce La(黄色)和C KA(绿色)综合EDX地图。为了证实Ag-Au纳米粒子的存在,从(A);(G)HAADF STEM图像;(H)Ag Lα(橙色)和Au Mα(白色)EDX地图和(I)区域EDX图谱中收集了第二个cryo-edX数据集。采用MαAu信号而不是Lα信号来避免Zn Kβ信号的干扰。
3.1.4低温阀杆EELS。
EELS可以在CTEM中的干燥样品上进行,但没有明显的空间分辨率(在衍射模式下),但我们已经表明,即使在相对较低的电子通量下,CTEM也会对玻璃体冰造成严重的破坏。另外,鳗鱼可以使用STEM进行操作,为了保存玻璃体冰,我们必须调整典型的SI设置参数,用于干燥样品。这是因为典型的SI扫描使用30s的像素驻留时间,1.3nm的像素大小和60 Pa的束流将产生108个e-/a2量级的总电子注量。我们已经指出,在STEM中超过4000 e-/a2的通量会对玻璃体冰造成损害。因此,我们建立了两种方法,其中鳗鱼可以在玻璃体标本上进行STEM。首先,如果很少或不需要空间分辨率,那么在低温条件下,光束可以连续扫描到整个视场,停留时间为5s,因为分光计收集能量信号(在整个扫描区域上平均),其总曝光量通常小于60s。在此条件下,总电子注量可达到3000 e-/a2量级(图5)。利用该收集装置,我们成功地从模型纳米粒子体系中识别出铁、铈和锌在低温条件下的损耗边缘。其次,如果需要高空间分辨率的元素映射,则可以使用替代的捕获参数(详见2.2节),这将导致Elnes的损失,但保留足够的信号从光谱映射元素。这项工作已在第3.2节中进行。冷冻-鳗鱼以前已经进行过,但这一直只使用低损耗(LL)鳗鱼(32-34)。由于探测器的前向定位,EELS是一种比EDX更有效的技术。然而,几乎所有的信号都来自前向散射的零损耗电子,只有很小一部分来自非弹性散射的电子,这些电子会产生核心损耗边。以往工作中使用的典型电子注量范围为25-1000 e-/a2(34),部分原因是需要防止对使用中的束敏感软物质样品造成损害,而且LL鳗鱼需要比芯损鳗鱼更短的曝光时间和较低的注量水平。
足够的电子计数。在这里,我们已经第一次展示了在低温条件下进行岩心损耗鳗鱼的可能性(图5和图7)。
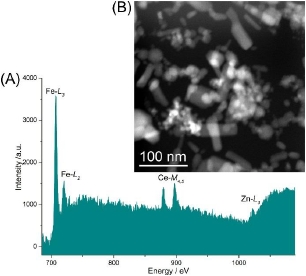
图5:多纳米颗粒悬浮液的冷鳗鱼.(A)采用0.25eV/ch色散,2.5mm入口孔径,660 eV HL漂移管,暴露60 s,225 kx停留时间5s,获得了背景减冷鳗鱼光谱。总电子注量为2000 e-/O2。708 eV处的FeL2,3白线边证实了Fe_2O_3纳米粒子的存在,CeM_4,5边在883-901 eV处证实了CeO_2的存在,而Zn L3边在1020 eV处证实了ZnO纳米粒子的存在。未获得Au或Ag边。(B)分析了该地区的Cryo-HAADF STEM图像。
低温分析STEM在固-液相互作用捕获中的应用
建立了玻璃体切片中STEM/EDX和EELS的基本方案,并将此技术应用于分散在细胞培养介质中的钛酸钡(BaTiO 3)纳米粒子的悬浮液中。BaTiO 3纳米粒子在医学领域有着广泛的应用,如医学成像和基因传递(35)。因此,对BaTiO 3的治疗效益和任何潜在的细胞毒性的细胞摄取研究都是以纳米粒子最初分散在细胞培养基(36,37)中进行的。这种复杂的水溶液含有一系列无机盐、维生素和氨基酸,经常补充FBS,其中含有有助于细胞生长的蛋白质。然而,当纳米粒子分散在细胞培养基(38,39)中时,已知存在显著的生物-纳米相互作用。因此,我们有兴趣应用冻库低温环境分析STEM来研究BaTiO 3纳米粒子与复杂介质之间的生物纳米界面,试图了解纳米粒子在更相关的体外/体内条件下的行为。
在我们之前的工作中,我们已经确定了在分散在冻库细胞培养介质中的钛酸钡纳米粒子周围形成的富含钙和磷的涂层(19)。这被认为是通过延伸浴超声制备样品的人造制品。此外,也许更重要的是,我们发现干燥的人造制品发生在传统的冻库制冷过程中,导致大量盐在纳米粒子周围积累。冷冻样品显示,在溶液中,所有的盐都保持溶解在钙和磷的来源,聚集在纳米粒子周围。如果不通过适当的超声处理,这种涂层将改变纳米粒子暴露在细胞中的表面化学,可能影响摄取和毒性。
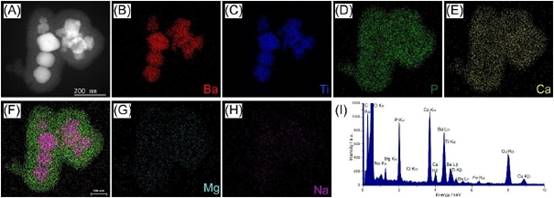
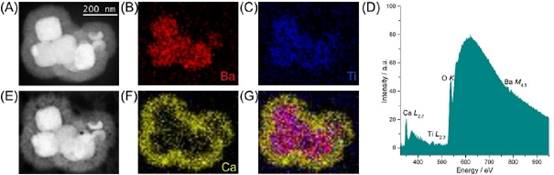
用总电子注量1800 e-/a2、探针电流60 Pa和2 nm像素大小绘制的茎-edX图谱显示了先前观察到的BaTiO 3纳米粒子周围形成的涂层(图6)。Na和Cl均为细胞培养基的组成成分,EDX图谱显示Na完全分散在悬浮液中。在细胞培养中也发现Mg,EDX谱中也有类似的观察,但Mg EDX图谱表明Mg可能存在于BaTiO 3纳米粒子周围的涂层中。众所周知,Mg2可以替代磷酸钙化合物中的Ca~(2+),我们认为这可能发生在这里。
图6:分散在CCCM中的BaTiO 3的cryo-edX地图。探针电流为60 Pa,停留时间为23μ,总扫描时间为251 s。总电子注量为2000 e-/O2。(A)HAADF STEM图像显示悬浮液中纳米粒子周围有一层涂层。EDX图谱证实纳米粒子中存在(B)Ba和(C)Ti,并确定涂层为(D)P,(E)Ca,(G)Mg含量较低。(H)Na是媒体的组成部分。(F)
包覆Ba La,Ti Ka,P Ka和Ca KA的X图谱。
为了尝试并获得有关钙磷沉淀形式的更多信息,执行STEMEELS。获得CaL2,3边,但PL2,3边被从90eV的BaN4,5边缘延伸的特征遮蔽。PL2,3的检测。
边界因难以拟合背景而变得复杂,根据以前的工作,使用了一阶对数多项式背景(40)。
BaTiO_3在EDX分析中的一个问题是在4.465(Lα)和4.508(Kα)keV分别用于元素量化和映射时很难解决(或解译)Ba和Ti信号。冷冻条件下的Si鳗鱼能够分离Ba和Ti信号(图7)。图7所示扫描的总电子注量为2000 e-/a2,使用40 Pa探针电流和10 nm像素大小。还可以看到一个清晰的Ca2,3边缘,其空间位置映射到纳米粒子周围的涂层位置。用130 eV的低损耗漂移管电压来获得PL2,3边缘,而不需要进行广泛的后处理,但这还没有成功。
图7:在低温冻库下拍摄的鳗鱼光谱图像-使用探针电流为40 Pa、像素大小为10 nm和像素停留时间为0.08s的条件下,总的通量为2000 e-/a2。(A)分析粒子的HAADF STEM图像;(B)Ba M4,5 MAP;(C)Ti L2,3 MAP;(D)分析区域的鳗鱼光谱;(E)分析后的HAADF STEM图像;(F)Ca L2,3 MAP;(G)Ba M4,5(红色),Ti L2,3(蓝色)和Ca L2,3(黄色)的组合图。Ca图谱在空间上分解了纳米粒子周围的涂层。532 eV处的大O K边缘是由于样品周围的玻璃化冰造成的。扫描前和扫描后的两张STEM图像显示,玻璃体冰层保持足够完整,颗粒能够保持原状,但在富钙涂层及其周围出现了一些损伤效应。
在这项工作中使用的电子通量远高于生物学研究中典型的电子通量。生物冷TEM成像通常采用小于10e-/a2的低电子注量进行。这不仅是为了维持玻璃化冰,也是为了处理光束敏感的有机软质物质。相比较而言,BaTiO 3是一种致密的纳米材料,不会受到明显的光束损伤,因此能够承受光谱分析所需的更高通量。高通量的STEM探针比CTEM更好地超越了由冰辐解产物引起的扩散损伤,这为探索STEM和CTEM开辟了机会。
特别是冷冻水合悬浮液的相对比STEM,如聚合物涂层,甚至有机物和药品(41,42)。
我们已经证明,冰晶纳米粒子在冻库复杂生物流体中的固液相互作用可以通过冷冻水分散体的冷分析STEM来识别和分析。STEM探针的高通量率使其能够在流场中获得良好的信噪比谱(EDX和EELS),对玻璃化冰的损伤最小,而包裹的纳米粒子由于在冰中明显的扩散有限损伤机制而没有明显的运动。这使我们能够识别和理解纳米粒子在复杂介质中的行为,特别是监测表面涂层的任何变化。这将有助于促进纳米医学和纳米毒理学领域的持续发展。
4. 结束( conclusion的名词复数 )
冻库环境中利用STEM分析是一个强有力的工具,通过它可以对冻结的玻璃状悬浮液中的纳米粒子进行精确的自然元素分析。它使电子注量可达2000 e-/O2,而不会对玻璃化冰基质造成重大损害。这比低温冻库中-CTEM成像(通常在<100 e-/a2时进行)要高,因为损伤率与扩散有限的玻璃体冰损伤引起的剂量率呈非线性关系。这是一个重要的发现,考虑到总电子注量的增加是通过STEM EDX/鳗鱼光谱获得纳米级元素地图的关键。通过对纳米粒子周围一层富钙、富磷涂层的鉴定,用冷分析STEM方法研究了BaTiO 3纳米粒子与完整细胞培养物组分的表面相互作用。这可能会影响生物标记物在细胞中的表面化学,当然也证明了这项技术的范围和意义。冷冻分析STEM将提供远比分析真空干燥样品更相关的信息,并将继续提高我们对悬浮纳米粒子的基本行为的理解,深入了解了冻库温度下的鳗鱼体液细胞的变化,达到根据不同产品提供特定的冻库试验环境。
如需了解更多重庆冷冻库,气调冷库,医药冷库,保鲜冷库,冷链物流冷库,冷库建造,冷库厂家等工程报价,及冷库板价格,冷库门造价,欢迎来电咨询! 百度搜索“中思民“或站内搜索您要的资讯!
重庆中思民节能科技有限公司网址:http://www.lengkuchangjia.com
我们将为您量身打造性价比高,适合您的专属冷库。
热线电话 陈先生:19122055459 余先生:19823299996 023-45489996
公司地址:重庆市铜梁区蒲吕街道办事处产业大道66号附2号






